化学反应的限度知识点
34化学反应的限度知识点
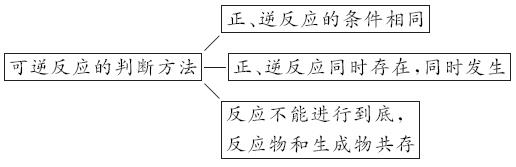
一 可逆反应
1.实例
(1)Cl2与H2O的反应Cl2+H2O

HCl+HClO
(2)FeCl3溶液和KI溶液的反应2Fe3++2I-

2Fe2++I2
2.可逆反应
(1)概念:在同一条件下既能向正反应方向又能向逆反应方向进行的化学反应。
(2)特征:在一定条件下,可逆反应有一定有限度,反应物不能完全转化为生成物。
(3)表示:在可逆反应的化学方程式中,用"

"号表示。
巧学助记
二 化学平衡状态(a/b)
1.化学平衡的建立
对于可逆反应2SO2+O2
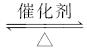
2SO3,在一定温度下,将2 mol SO2(g)和1 mol O2(g)通入一定体积的密闭容器中。其化学反应速率与时间关系如图所示。分析回答下列问题:
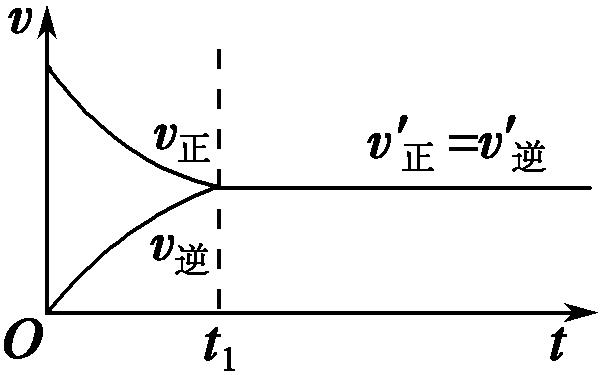
(1)反应开始时:v(正)最大,v(逆)为0,原因是反应物浓度最大,生成物浓度为0。
(2)反应过程中:v(正)逐渐减小,v(逆)逐渐增大,原因是反应物浓度逐渐减小,生成物浓度逐渐增大。
(3)反应一段时间(t1)后,v(正)=v(逆),反应物和生成物的浓度不再改变。
2.化学平衡状态
(1)概念:在一定条件下,可逆反应进行到一定程度时,正反应速率与逆反应速率相等,反应物和生成物的浓度不再发生变化,这种状态称为化学平衡状态。
(2)特征
①逆:只有可逆反应才能在一定条件下建立化学平衡状态。
②等:反应达到平衡时,v(正)=v(逆)。
③动:化学平衡状态是一种动态平衡。达到平衡状态时,正反应和逆反应都依然在进行。
④定:条件一定时,反应物的浓度和生成物的浓度不再改变。
⑤变:外界条件发生改变时,原平衡状态被破坏,并在新的条件下建立新的化学平衡状态。
巧学助记
化学平衡状态的判断方法
(1)v(正)=v(逆)。
(2)混合物中各组分的百分含量不变(除百分含量外其他在反应过程中变化的量,达到平衡后均不再发生变化,即"变化量达不变")。
发表评论



暂时没有评论,来抢沙发吧~